التیام زخم با استفاده از چاپ سه بعدی
پوست به عنوان لایه دفاعی اولیه بدن انسان، نقش مهمی در سلامت بدن دارد. اختلالات پوستی پس از صدمات مانند سوختگی، زخم دیابتی، زخم وریدی ساق پا، و سایر آسیب های فیزیکی در بسیاری از مطالعات اخیرا مورد بررسی قرار گرفته است . در حالی که پزشکان معمولا پیوند اتولوگ را توصیه می کنند، درمان های جایگزین به دلیل بروز بالای آسیب های پوستی وجود دارد. مهندسی بافت به عنوان یک زمینه آینده نگر و چند رشته ای پزشکی بازساختی می تواند مواد زیستی را با نانوذرات برای التیام زخم های عمیق ترکیب کند . ایجاد بافتهای مصنوعی یا جایگزینهای پوستی که عملکردی، زیستسازگار، و از نظر مکانیکی و شیمیایی مقاوم باشند، هنوز یک مبارزه بزرگ است. به دلیل ماهیت پیچیده و ویژگی های ناهمسانگرد، تراز کردن پروتئین ها، سلول ها و سایر عوامل فعال در یک نظم خاص در بافت پوست انسان اهمیت دارد.
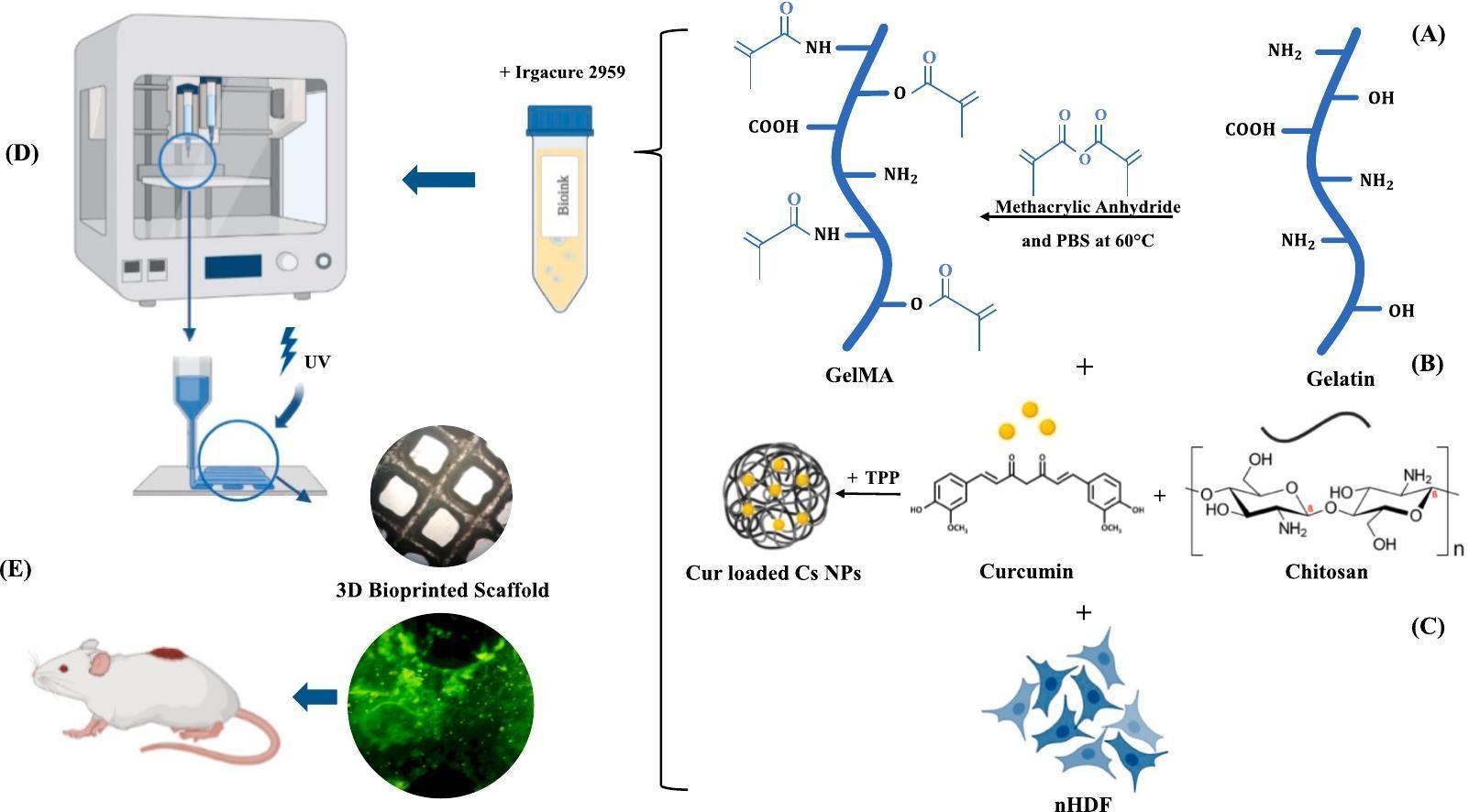
هدف از اعمال داربست مهندسی بافت، ساخت ماتریکس خارج سلولی (ECM) با شبیه سازی ماتریکس طبیعی بدن است. به عنوان روشی برای مونتاژ داربست، چاپ زیستی به طور فزاینده ای در مهندسی بافت و پزشکی احیا کننده محبوب شده است. جوهرهای زیستی متشکل از مواد زیستی، نانوذرات و سلولها را میتوان با طراحی به کمک کامپیوتر (CAD) در اشکال دلخواه و متنوعی که بافت بدن را تقلید میکند، چاپ کرد . ایمپلنتولوژی، پزشکی احیا کننده و مهندسی بافت همگی از کاربرد این فناوری بهره مند شده اند . در یک فرآیند مبتنی بر اکستروژن، لایههایی از مواد زیستی یا جوهر زیستی حاوی مولکولها یا سلولهای فعال بیولوژیکی بر روی یک مدل از پیش طراحیشده توزیع میشوند تا یک شی قابل لمس را تشکیل دهند. با استفاده از این سیستم، جوهرهای هیدروژل ابتکاری و تقلید کننده بافت را می توان تولید و به عنوان پانسمان ترمیم کننده زخم بدون نیاز به روش های تهاجمی استفاده کرد .
استفاده از عوامل زیست فعال برای عملکرد شبکه های هیدروژل، مانند مولکول های تعدیل کننده ایمنی، فاکتورهای رشد یا عوامل ضد باکتری، می تواند چندین مزیت را ایجاد کند . علاوه بر تقویت بهبود زخم، می توان از آن برای آزادسازی بیومولکول ها در محل زخم به روشی آهسته و پایدار استفاده کرد. هیدروژل ها یکی از بیوموادهایی هستند که در پرینت زیستی سه بعدی برای ایجاد یک ریزمحیط نفوذپذیر و مناسب انجام می شوند. علاوه بر این، هیدروژلها میتوانند شبکههای متقاطع ایجاد کنند که شبیه به ECM است که به طور طبیعی در بدن یافت میشود و به اکسیژن و مواد مغذی اجازه میدهد تا به سلولها نفوذ کنند تا رشد و تمایز را افزایش دهند. همچنین، آنها می توانند به طور موثر نانوذرات حاوی دارو را در داخل ماتریکس خود محصور کنند. آنها می توانند یک محیط مرطوب فراهم کنند و بافت نکروزه را برای بهبود زخم از بین ببرند.
بیوپلیمرهای طبیعی و مصنوعی برای تولید هیدروژلها استفاده میشوند که در این میان پلیمرهای دارای منابع طبیعی به دلیل گنجاندن بیومولکولها و پپتیدها از مزیت خاصی برخوردارند زیرا رشد، تکثیر، تمایز، مهاجرت و چسبندگی سلول را تقویت میکنند . ژلاتین، به عنوان مشتق هیدرولیز کلاژن، دارای کیفیت های بیولوژیکی مناسبی است، شبیه ECM بافت طبیعی است و حاوی آرژنین-گلیسین-اسپارتیک اسید (RGD) و توالی هایی از ماتریکس متالوپروتئیناز (MMP) است که به طور قابل توجهی خواص بیولوژیکی داربست را افزایش می دهد . با این حال، ژلاتین خالص به دلیل سرعت بالاتر تخریب، ناپایداری شکل و خواص مکانیکی پایین تر، به عنوان کشت بافت و بیووانک عمل نمی کند. ژلاتین متاکریلات (GelMA)، شکل اصلاح شده ژلاتین که در ابتدا توسط Van Den Bulcke و همکارانش سنتز شد. یکی از رایج ترین جوهرهای زیستی با اتصال متقاطع عکس و حساسیت حرارتی مناسب است. GelMA، یک پلیمر زیستی با ویژگی های مکانیکی مناسب، زیست سازگاری، ضد التهاب و زیست تخریب پذیری، اخیراً مورد توجه قابل توجهی در برنامه های کاربردی برای ترمیم زخم قرار گرفته است . اصلاح شیمیایی GelMA بر ستون فقرات پلیمر یا وجود نقوش RGD که برای برهمکنشهای بیومتریال با سلولها لازم است، تأثیر نمیگذارد . به دلیل متابولیسم و بقای سلولی بالا، غلظت های پایین GelMA (<5٪) اغلب به عنوان جوهر زیستی استفاده می شود . با این حال، هیدروژل های کم غلظت منجر به شکل های نامنظم می شوند که از بی ثباتی ناشی از فرآیند در طول اکستروژن رنج می برند .
از سوی دیگر، غلظتهای بالاتر از 15 درصد، قابلیت چاپ عالی را نشان میدهند و در عین حال زندهمانی سلول را کاهش میدهند . چاپ زیستی GelMA همراه با ژلاتین توسط یین و همکاران مورد مطالعه قرار گرفته است. با غلظت های مختلف 5-30 درصد که نتایج موفقیت آمیزی به دست آورد . علاوه بر این، کامپوزیت های GelMA دارای ویژگی های مکانیکی و بیولوژیکی برتر در مهندسی بافت های مختلف، به عنوان مثال، ترمیم زخم پوست، مهندسی بافت قلب، مهندسی بافت استخوان، و ترمیم عصب هستند.
اخیراً نانوذرات پلیمری پلی ساکارید مانند کیتوزان در شبکههای داربست بارگذاری میشوند تا بهبود زخم را بهبود بخشند . کیتوزان از استیلزدایی کیتین تشکیل میشود که شامل زیرواحدهای D-گلوکزامین و N- استیل D-گلوکزامین است که توسط پیوندهای گلیکوزیدی β-1،4 به یکدیگر متصل شدهاند . علاوه بر تقویت هموستاز، نانوذرات کیتوزان دارای خواص ضد میکروبی نیز هستند، رادیکالهای آزاد را از بین میبرند و التهاب را تعدیل میکنند . زردچوبه حاوی یک ترکیب آنتی اکسیدانی، ضد التهابی و ضد عفونی به نام کورکومین است که بیان فاکتور رشد تبدیل کننده β (TGF-β) و پروتئین های ECM را نیز افزایش می دهد . با این حال، علیرغم بهبود سرعت بهبود زخم و ویژگیهای بیولوژیکی مثبت کورکومین، از فراهمی زیستی و پایداری ضعیف رنج میبرد . همچنین، به دلیل دریافت پلی فنول های موجود در کورکومین، می تواند در غلظت های بالا سمی باشد. در نتیجه، یک مکانیسم تحویل کنترل شده مورد نیاز است. گزارش شده است که نانوذرات کیتوزان مملو از کورکومین میتواند با افزایش تکثیر فیبروبلاست و فعال کردن ماکروفاژها و سلولهای التهابی باعث بهبود زخم شود.
در این راستا، این مطالعه با هدف طراحی و به کارگیری یک بیوکمپوزیت جدید متشکل از بیوئینک مبتنی بر GelMA به عنوان داربست و نانوذرات کیتوزان بارگذاری شده با کورکومین (CSNP) است. در اینجا، نوآوری اصلی ترکیب CSNP ها در هیدروژل های GelMA چاپ زیستی سه بعدی به منظور ایجاد رهاسازی پایدار است که برای بهبود زخم ایده آل و سودمند است. علاوه بر این، مقدار کراسلینکر اضافه شده به داربست کمتر از داده های منتشر شده قبلی است. در نتیجه، مخلوطی از GelMA و نانوذرات با غلظتهای مختلف مورد تجزیه و تحلیل قرار گرفت و غلظتهای بهینه آنها با استفاده از یک چاپگر زیستی اکستروژن سه بعدی برای ساخت ساختارهای سهبعدی تهیه و چاپ زیستی شد و سپس با قرار گرفتن در معرض نور ماوراء بنفش به صورت متقابل پیوند زدند. در نتیجه توسعه موفقیتآمیز پانسمان زخم GelMA/CSNP/Curcumin، سایر داروهای طبیعی را میتوان با استفاده از همان استراتژی در برنامههای بهبود زخم به کار برد.
:References
https://www.sciencedirect.com/science/article/abs/pii/S2772950823004004