(فلورسنت (Fluorescent): به خاصیتی اشاره دارد که در آن یک ماده، نور مرئی را جذب کرده و سپس آن را با طول موج بلندتر (معمولاً به شکل نور مرئی) منتشر میکند. این پدیده معمولاً تحت تابش نور فرابنفش (UV) اتفاق میافتد و باعث درخشش ماده میشود.)
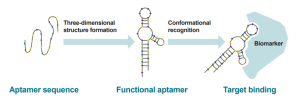
“آپتامر” یک قطعه کوتاه از DNA است که میتواند به طور خاص به مولکولهای هدف متصل شود.
چکیده
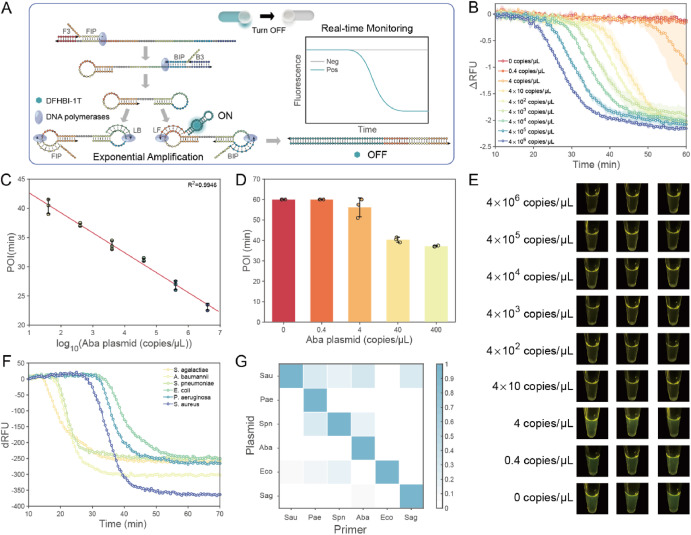
فنآوریهای تشخیص اسید نوکلئیک مبتنی بر تقویت ایزوتِرمال به ابزارهای سریع و کارآمدی برای تشخیص مولکولی تبدیل شدهاند. روشهای نظارت بر توالی خاص برای “تقویت ایزوتِرمال” حیاتی هستند، زیرا به شناسایی بروز دیمرهای پرایمر گسترده کمک میکنند که میتوانند منجر به نتایج مثبت کاذب شوند.
(پرایمر(Primer) یک توالی کوتاه ازDNA یا RNA است که معمولاً بین ۱۸ تا ۲۵ نوکلئوتید طول دارد و به عنوان نقطه شروع برای سنتز DNA عمل میکند. پرایمرها در فرآیندهای مختلف زیستشناسی مولکولی، به ویژه در واکنش زنجیرهای پلیمراز (PCR) و تکثیر DNA، نقش اساسی دارند.)
(تمهندسی آپتامر DNA فلورسنت یا (Sequence-Specific Isothermal Amplification) به روشهایی اشاره دارد که در آن یک توالی خاص از DNA یا RNA در دمای ثابت (ایزوترمال) تکثیر میشود.)
( بروز دیمرهای پرایمر گسترده معمولاً در زمینههای زیستشناسی مولکولی و PCR (واکنش زنجیرهای پلیمراز) استفاده میشود. دیمرهای پرایمر زمانی اتفاق میافتند که دو پرایمر به جای اتصال به DNA هدف، به یکدیگر متصل شوند. اگر این اتصال به صورت گسترده (extended) باشد، ممکن است باعث ایجاد محصولات ناخواسته در PCR شود و نتایج آزمایش را تحت تأثیر قرار دهد.)
(مثبت کاذب (False Positive) به نتیجهای اشاره دارد که به اشتباه نشاندهندهی وجود یک شرایط یا ویژگی خاص است، در حالی که در واقعیت آن شرایط یا ویژگی وجود ندارد. به عبارت دیگر، نتیجهی آزمایش یا تست به اشتباه مثبت گزارش میشود)
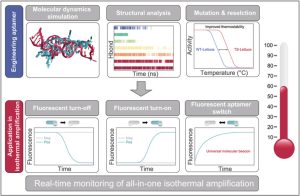
آپتامرهای فلورسنت ابزارهای امیدوارکنندهای برای نظارت مداوم بر تقویت ایزوتِرمال هستند، اما به طور ذاتی محدود به پایداری حرارتی هستند. در اینجا، ما یک نوع مهندسیشده از آپتامر دیانای فلورسنت به نام Lettuce” با پایداری حرارتی” (TS-Lettuce مخفف thermostable Lettuce ) را گزارش میدهیم که دمای ذوب ۵ درجه سانتیگراد بالاتر و فلورسانس ۲۰ برابر بیشتر در ۶۰ درجه سانتیگراد دارد و برای نظارت مداوم بر تقویت ایزوتِرمال توالی خاص(Sequence-Specific Isothermal Amplification )، ایدهآل است. با استفاده از شبیهسازیهای دینامیک مولکولی برای تحلیلهای ساختاری، ما جهشهایی را در نوع وحشی Lettuce معرفی کردیم تا توالیهای غیر هستهای ساختار آپتامر را بازطراحی کنیم و تاشدگی آن را تثبیت نماییم، که در نتیجه پایداری حرارتی آن افزایش یافت.
(شبیهسازی دینامیک مولکولی (Molecular Dynamics Simulations) یک روش محاسباتی قدرتمند در علوم زیستی، شیمی، فیزیک و مهندسی است که برای مطالعه و پیشبینی رفتار اتمها و مولکولها در طول زمان استفاده میشود. در این روش، حرکت و تعاملات بین اتمها و مولکولها با استفاده از قوانین فیزیک و معادلات ریاضی شبیهسازی میشود.)
(منظور از توالیهای غیرهستهای در ساختار آپتامر، بخشهایی از توالی نوکلئوتیدی (DNA یا RNA) است که در تشکیل ساختار سهبعدی عملکردی آپتامر نقش مستقیم و اساسی ندارند. این توالیها معمولاً در نواحیای قرار میگیرند که برای اتصال به هدف (لیگاند) یا ایجاد ساختارهای ثانویه و سهبعدی ضروری نیستند.)
نسخهی TS-Lettuce انعطافپذیری بیشتر و طراحی سادهتری را برای اتصال به روشهای تکثیر ایزوترمال فراهم میکند و امکان تشخیص یکپارچهی اسیدهای نوکلئیک را ممکن میسازد. ما سه کاربرد از TS-Lettuce را در تقویت ایزوتِرمال نشان دادیم: خاموش شدن فلورسانس، روشن شدن فلورسانس و تغییر وضعیت آپتامر فلورسنت، که شناسایی توالی خاص اسیدهای نوکلئیک را تسهیل میکند. علاوه بر این، نتایج تولیدشده توسط TS-Lettuce برای چشم غیرمسلح قابل مشاهده است، که سودمندی واکنشهای تقویت ایزوتِرمال را در مناطق با منابع محدود ارتقا میدهد. آپتامرهای دیانای فلورسنت حرارتی پایدار میتوانند در سایر روشهای تقویت ایزوتِرمال نیز مورد استفاده قرار گیرند.
مقدمه
مولکولهای دیانای به عنوان حاملهای اطلاعات ژنتیکی عمل میکنند و همچنین عملکردهای پیچیده بیوشیمیایی یا بیوفیزیکی را از خود نشان میدهند که به توالیهای نوکلئوتیدی خاص بستگی دارند (Nakano et al., 2014; Watson and Crick, 1953). بهعنوان مثال، دیانای با فرمهای ساختاری خاص میتواند به طور پیچیدهای بیان ژنها را تنظیم کند (برای مثالG-quadruplexes)
(Basu et al., 2021; Huang et al., 2017; Park et al., 2024; Varshney et al., 2020; Xie et al., 2022)
مولکولهای هدف را شناسایی کند (برای مثال، آپتامرها) (Sefah et al., 2010)، یا واکنشهای بیوشیمیایی را کاتالیز کند (برای مثال، ریزوزیمها) (Breaker, 1997). بر این باورند که این عملکردهای غیرمارپیچی دیانای عمدتاً به تاخوردگی سهبعدی پیچیده آن که شامل پیوندهای هیدروژنی گسترده بین بازها، نیروهای واندروالس و تعاملات الکتروستاتیکی است، بستگی دارند.
(Takahashi and Sugimoto, 2020; Tateishi-Karimata and Sugimoto, 2020)
این تعاملات قابل برنامهریزی، اصول جدیدی برای خودسازماندهی دیانای ارائه میدهند.
آپتامرهای فلورسنت یک دسته از مولکولهای عملکردی DNA یا RNA هستند که میتوانند به مولکولهای کوچک با فلورسانس ضعیف متصل شوند و فلورسانس آنها را چندین هزار برابر افزایش دهند، عمدتاً از طریق محکم کردن انتقال بار درونمولکولی پیچیده (rigidifyingtwisted intramolecular charge transfer (TICT)) _مبنی بر فلوروفورها
(Babendure et al., 2003; Dolgosheina et al., 2014; Filonov et al., 2014; Paige et al., 2011; Song et al., 2017)
با وجود اینکه تعیین ساختار چندین آپتامر فلورسنت معماریهای گوناگون و بیربط کلی را آشکار کرده است، بیشتر آپتامرها فلورسانس را از طریق آرایشهای مسطح چندین نوکلئوباز، بهویژه G-quadruplexes، که لیگاند را به فرم مسطح محدود میکنند، فعال میکنند.
(Huang et al., 2021; L.F. Passalacqua et al., 2023; Trachman III et al., 2018; Trachman et al., 2017; Warner et al., 2014)
این آپتامرهای فلورسنت کاربردهای گستردهای در تصویربرداری RNA و پروتئین در داخل بدن، همچنین در تشخیص مولکولهای کوچک، پروتئینها و اسیدهای نوکلئیک در محیط آزمایشگاهی دارند.
(Chen et al., 2019; Lu et al., 2023; Truong and Ferré-D’Amaré, 2019)
مهندسی بیشتر ساختار آپتامرهای فلورسنت احتمالاً به تسهیل طراحی و بهینهسازی ویژگیهای آنها کمک خواهد کرد، بهطوری که برای کاربردهای خاص سفارشی شوند (Luo et al., 2019; Qi et al., 2023).
در دو دهه گذشته، فنآوریهای تشخیص اسید نوکلئیک مبتنی بر تقویت ایزوتِرمال به عنوان ابزارهای تشخیص مولکولی کارآمد ظهور کرده اند و پتانسیل بالایی برای کاهش هزینهها، افزایش سرعت و کمینه کردن مصرف نمونهها و معرفها دارند.
(Oliveira et al., 2021; Zhao et al., 2015, 2021)
این فناوریها نوید جایگزینی روشهای سنتی و زمانبر واکنش زنجیرهای پلیمراز کمّی (qPCR) را در محیطهای با منابع محدود، میدهند. با این حال، حساسیت و ویژگیهای تحلیلی این تکنیکهای تقویت ایزوتِرمال حساسیت و ویژگی تحلیلی این تکنیکهای تقویت همدما اغلب توسط تقویت غیر اختصاصی اجتنابناپذیر به خطر میافتد. (Becherer et al., 2020; Gao et al., 2019)
روشهای توالیخاص باید برای تأیید محصولات تقویت ایزوتِرمال و ارائه نظارت مداوم توسعه یابند؛ برای مثال نظارت بر، نشانگرهای مولکولی، پروبهای جابهجایی رشته، جابهجایی میانجیگرها، پروبهای قابلشکست توسط اندونوکلئاز و غیره …
(Becherer et al., 2018, 2020; Jiang et al., 2015; Wang et al., 2015).
با این حال، بیشتر این روشها نیاز به برچسبگذاری فلورسنت یا اصلاحات شیمیایی دارند که عدم تطابق عمومی و راحتی را به همراه دارند. آپتامرهای فلورسنت به عنوان پروبهای مولکولی توالیخاص بدون نیاز به برچسب، خوانشهای فلورسنت سریع و بدون نیاز به آنزیم را ارائه میدهند. برخی از تکنیکهای تقویت ایزوتِرمال که با آپتامرهای فلورسنت ترکیب شدهاند گزارش شدهاند، از جمله سیستمهای آپتامر تقسیمشده، سیستمهای مبتنی بر رونویسی و سوئیچهای آپتامر.
(Liang et al., 2024; VarnBuhler et al., 2022; Yan et al., 2024).
با این حال، این استراتژیها محدود به سازگاری آنزیمها و دما هستند. زیرا تولید آپتامرهای فلورسنت RNA به سیستمهای رونویسی بستگی دارد که نیاز به آنزیمهای رونویسی و بافرهای مربوطه دارند.
(Neubacher and Hennig, 2019; Trachman and Ferré-D’Amaré, 2019).
علاوه بر این، کارآیی ترکیب آپتامرهای فلورسنت با برخی از تقویتهای ایزوتِرمال، مانند تقویت ایزوتِرمال حلقهمحور (LAMP) که بهطور بهینه در دمای 55–65 درجه سانتیگراد کار میکند، به دلیل حساسیت گرمایی آپتامرها بهینه نیست. این محدودیتها مانع استفاده از آپتامرهای فلورسنت را در تقویت ایزوتِرمال میشود.
در این مطالعه، ما یک واریانت مهندسیشده از آپتامر دیانای فلورسنت به نام Lettuce حرارتی پایدار (TS-Lettuce) گزارش میدهیم که نشاندهنده افزایش ۵ درجه سانتیگراد در دمای ذوب و افزایش ۲۰ برابری در فلورسانس در دمای ۶۰ درجه سانتیگراد نسبت به Lettuce نوع وحشی است.
“واریانت” به یک نسخه مهندسیشده و بهبودیافته از آپتامر Lettuce اشاره دارد که به دلیل اصلاحات ساختاری، ویژگیهای بهتری مانند پایداری حرارتی بیشتر و افزایش شدت فلورسانس دارد. در مقابل، “نوع وحشی” (Wild-type) به نسخه اصلی و طبیعی Lettuce اشاره دارد که بدون این اصلاحات مهندسیشده است. به عبارت دیگر، TS-Lettuce یک واریانت یا نسخه تغییریافته از Lettuce وحشی است که عملکرد بهتری در دمای بالا دارد.
این بهبود از طریق طراحی و انتخاب مجدد توالیهای غیر هستهای ساختار آپتامر برای تثبیت دقیق تاخوردگی آن به دست آمد. آپتامر دیانای فلورسنت حرارتی پایدار، انعطافپذیری بیشتر و طراحی آسانتری را ارائه میدهد و امکان ترکیب آن با تقویت ایزوترمال را برای تشخیص یکپارچه اسید نوکلئیک فراهم میکند. ما سه کاربرد از TS-Lettuce را در تقویت ایزوتِرمال نشان دادیم: خاموش شدن فلورسانس، روشن شدن فلورسانس و سوئیچهای آپتامر، که شناسایی انواع مختلف اسیدهای نوکلئیک از جمله دیانای و آرانای را تسهیل میکند. بنابراین، TS-Lettuce بهعنوان یک نشانگر مولکولی قدرتمند و چندمنظوره برای تقویت ایزوتِرمال عمل میکند و امکان تشخیصهای مولکولی سریع، کمهزینه و قابل حمل را فراهم میآورد.
واکنش دهنده ها و مواد شیمیایی
مواد شیمیایی و واکنشدهنده ها از تولیدکنندگان مختلفی که در جدول تکمیلی ذکر شده است، تهیه شدند. تمام اولیگونوکلئوتیدهای DNA و RNA توسط Sangon Biotech (Shanghai) Co., Ltd سنتز و تصفیه شدند.
(اولیگونوکلئوتیدها (Oligonucleotides) به زنجیرههای کوتاه از نوکلئوتیدها (واحدهای ساختاری دیانای یا آرانای) گفته میشود که معمولاً شامل ۲ تا ۵۰ نوکلئوتید هستند.)
و پلاسمیدهای باکتریایی توسط Tsingke Biotechnology Co., Ltd. (پکن، چین) سنتز شدند.
(پلاسمیدها در مهندسی ژنتیک به عنوان حاملهای ژنتیکی (vectors) استفاده میشوند. این پلاسمیدها میتوانند ژنها یا توالیهای خاصی را که نیاز به تکثیر یا تولید دارند، حمل کنند و به باکتریها منتقل شوند. همچنین با استفاده از پلاسمیدها میتوان باکتریها را مهندسی کرد تا مواد شیمیایی مفید تولید کنند.)
تمام توالیهای DNA و RNA در جداول تکمیلی S1، S2 و S3 ذکر شده است.
DNA فردی در غلظت 100 میکرومولار در بافر 1× 20) میلیمتر تریس-HCl، 10 میلیمتر (NH4)2SO4، 50 میلیمتر KCl، 2 میلیمتر MgSO4، 0.1% توئین 20 PH ( معلق شد.
(بافر (Buffer) یک محلول شیمیایی است که قادر است pH خود را در برابر تغییرات اسیدی یا بازی ثابت نگه دارد.)
(منظور از معلق شدن DNA در بافر این است که دیانای به طور فیزیکی در بافر شناور است، بدون اینکه در آن رسوب کند یا تهنشین شود.)
طراحی و شناسایی Lettuce حرارتی پایدار
Lettuce یک آنالوگ DNA از پروتئینهای فلورسانس سبز (GFP) است که قادر به اتصال و فعالسازی فلوروفورهایی مانند DFHBI-1T، DFHO و DFAME میباشد.Ferré-D’Amaré و همکاران نشان دادند که Lettuce ساختار چهارگانه (4WJ) را اتخاذ میکند، که در آن چهار ساقه تشکیل دو مجموعه هممحور میدهند که به صورت خطی همراستا شده و یک
G-quadruplex مرکزی ایجاد میکند (L.F.M. Passalacqua et al., 2023).. فلوروفور میتواند بین مناطق G4 (Q2) و P1.1 متصل شده و تعاملات گستردهای با آنها داشته باشد.
(این متن توضیح میدهد که یک آنالوگ دیانای خاص(Lettus) از پروتئینهای فلورسانس سبز (GFP) میتواند به فلوروفورهایی مانند DFHBI-1T، DFHO و DFAME متصل شود و آنها را فعال کند. این مولکول دارای ساختاری به نام
G-quadruplex است که در آن رشتههای دیانای بهصورت خاص چیده شدهاند و این ساختار برای تعامل با فلوروفورها ضروری است. این ویژگیها به محققان این امکان را میدهند که از این مولکولها در کاربردهای فلورسانس و شبیهسازیهای مولکولی استفاده کنند.)
نتیجهگیری
در مقایسه با روشهای سنتی شناسایی اسید نوکلئیک، تکنیکهای تقویت ایزوتِرمال پتانسیل زیادی دارند زیرا از هزینه کمتر، زمان بازخورد کوتاهتر و مصرف کمتر نمونه و واکنشگرها برخوردار هستند، بهویژه در محیطهای مراقبت در محل (POC)( منظور از محیط POC (Point of Care) مکانی است که در آن آزمایشها یا ارزیابیهای پزشکی بهطور مستقیم و در همان محل درمان یا مراقبت از بیمار انجام میشود.
با این حال، بسیاری از آنزیمهای تقویت ایزوتِرمال فاقد فعالیت 5′-3′ اگزونوکلئاز هستند، که این مسئله باعث دشواری در دستیابی به نظارت خاص به طور مداوم، مشابه به Taqman probes در PCR میشود. آپتامرهای فلورسانت میتوانند با تقویت ایزوتِرمال ترکیب شوند تا این چالشها را حل کنند
اگزونوکلئازها آنزیمهایی هستند که قادرند نوکلئوتیدها) واحدهای سازنده DNA یا (RNA را از یک رشته نوکلئوتیدی جدا کنند. فعالیت 5′-3′ اگزونوکلئاز به معنی توانایی آنزیم در حذف نوکلئوتیدها از انتهای 5′ (انتهای پنجموقعیتی) رشته دیانای به سمت انتهای 3′ (انتهای سهموقعیتی) است..
بیانیه مشارکت نویسندگان CRediT
- Li Zhang: نوشتن – مرور و ویرایش، نوشتن – پیشنویس اصلی، تجسم، اعتبارسنجی، نرمافزار، روششناسی، تحقیق، تحلیل رسمی، گردآوری دادهها، مفهومیسازی.
- Tong Feng: نوشتن – مرور و ویرایش، اعتبارسنجی، روششناسی، تحقیق، مفهومیسازی.
- Qian Liu: نوشتن – مرور و ویرایش، منابع، روششناسی، مفهومیسازی.
- Chen Zuo: نوشتن – مرور و ویرایش، منابع، روششناسی.
- Yongchang Wu: نوشتن – مرور و ویرایش، اعتبارسنجی، منابع.
بیانیه تعارض منافع
نویسندگان اعلام میکنند که هیچگونه منافع مالی یا روابط شخصی که ممکن است بر تحقیق گزارششده در این مقاله تأثیر گذاشته باشد، ندارند.
قدردانی
این تحقیق از حمایت مالی برنامه ملی R&D چین (2022YFC2603800)، بنیاد ملی علوم طبیعی چین
(82372351 و 82172369)، و برنامه CQMU برای نوآوری جوانان در پزشکی آینده (W103) برخوردار بوده است.
جمع بندی
مقاله فوق در رابطه با یک تحقیق علمی در زمینه طراحی و استفاده از آپتامرهای DNA فلورسنت با پایداری حرارتی برای تقویت اسیدهای نوکلئیک در شرایط هم دمایی است. این تحقیق به مطالعهی ساختار و عملکرد آپتامرهای فلورسنت، بهویژه نوع مهندسیشدهای به نام “TS-Lettuce” میپردازد که بهطور خاص برای تقویت ایزوتِرمال طراحی شدهاند.
آپتامرهای DNA در این تحقیق به عنوان ابزارهای خاص برای تشخیص اسیدهای نوکلئیک استفاده میشوند. این آپتامرها میتوانند با فلوروفورها تعامل کرده و فلورسانس را فعال کنند، که برای نظارت بر تقویت ایزوتِرمال و شناسایی توالیهای خاص DNA یا RNA استفاده میشود. یکی از چالشهای اصلی در این زمینه، پایداری حرارتی آپتامرها است که با توجه به دماهای بالای مورد نیاز برای تقویت ایزوتِرمال ممکن است دچار افت عملکرد شوند.
نوع مهندسیشدهی “TS-Lettuce” به طور ویژه برای افزایش پایداری حرارتی طراحی شده است و بهطور چشمگیری عملکرد فلورسانس بهتری در دماهای بالاتر نشان میدهد. این مطالعه همچنین نشان میدهد که TS-Lettuce قادر است تا با تکنیکهای مختلف تقویت ایزوتِرمال (مانند خاموش شدن و روشن شدن فلورسانس و سوئیچهای آپتامر) به شناسایی دقیقتر و سریعتر اسیدهای نوکلئیک کمک کند.
نتایج این تحقیق میتواند برای تشخیص مولکولی سریع و کارآمد، به ویژه در محیطهای با منابع محدود، مفید باشد و از آن در کاربردهای مختلفی چون تشخیص بیماریها و مطالعات ژنتیکی استفاده شود.
منابع:
https://www.sciencedirect.com/science/article/abs/pii/S0956566325000570?dgcid=rss%5C_sd%5C_all
- J. Huang et al.
Metal ion detection using functional nucleic acids and nanomaterials
Biosens. Bioelectron.
(2017)
- J. Liang et al.
Chem. Eng. J.
(2024)
- S. Qi et al.
Chem. Eng. J.
(2023)
- G.A. Soukup et al.
Altering molecular recognition of RNA aptamers by allosteric selection
- Mol. Biol.
(2000)
- Robert J. Trachman et al.
Structural principles of fluorescent RNA aptamers
Trends Pharmacol. Sci.
(2017)
- B.S. VarnBuhler et al.
Detection of SARS-CoV-2 RNA using a DNA aptamer mimic of green fluorescent protein
ACS Chem. Biol.
(2022)
- Yi Wang et al.
- Mol. Diagn.
(2015)
- Z. Xie et al.
Int. J. Biol. Macromol.
(2022)
- Z. Yan et al.
Chem
(2024)
- T. Yoon et al.
Biosens. Bioelectron.
(2022)