اندام تراشه چیست؟
ارگان روی یک تراشه (Organ on a chip) یا اندام تراشه نوعی کشت سلولی سه بعدی است که اجزای مختلف آن روی یک مدار مجتمع (تراشه) پیادهسازی شدهاند. این فناوری با هدف شبیهسازی فعالیتها، ویژگیهای تخصصی و پاسخ فیزیولوژیکی کل اندام یا بخشی از یک اندام طراحی شده است.
پیشرفت قابل توجه در زیست مواد، زیست شناسی سلول های بنیادی و تکنولوژی های ریز مقیاس، ساخت بافت ها و اندام های مرتبط از نظر زیستی را مقدور ساخته است. چنین بافت ها و اندام هایی که تحت عنوان پلت فرم های organ-on-a-chip شناخته می شوند، به عنوان ابزاری قوی در آنالیزهای بافتی و مدل سازی برای کاربردهای زیستی و دارویی ظهور کرده اند.
ساختن اندامهای مصنوعی نه تنها نیازمند دستکاری دقیق سلولی است، بلکه به درک دقیق واکنشهای پیچیده و بنیادی بدن انسان نیاز دارد. بدن شبکه پیچیدهای از فرآیندهای فیزیولوژیکی است که شبیهسازی یک اندام را به چالش می کشد.

در میان اندامهایی که روی تراشه مدلسازی شدهاند، کبد بهدلیل نقش کلیدیاش در متابولیسم و سمزدایی، جایگاه ویژهای دارد. بازآفرینی آن در مقیاس میکرو، گامی مهم در شبیهسازی پاسخ بدن به داروهاست. این عضو پیچیده ، در فرآیندهای متابولیکی، ذخیرهسازی مواد مغذی، سمزدایی و تولید پروتئینهای ضروری نقش دارد.
سمزدایی (Detoxification)
کبد با فیلتر کردن خون و تجزیه موادی مانند الکل، داروها و سموم، نقش اصلی را در سمزدایی بدن ایفا میکند. این فرآیند در سه مرحله انجام میشود که دو مرحله اول در کبد و مرحله نهایی در کلیه، روده یا سیستم لنفاوی صورت میگیرد.
در فاز اول، آنزیمهای کبدی (مانند سیتوکروم P450) با واکنشهایی مثل اکسیداسیون و هیدرولیز، سموم را به ترکیبات کمتر مضر تبدیل میکنند. این مرحله رادیکالهای آزاد تولید میکند که برای جلوگیری از آسیب، به آنتیاکسیدان نیاز دارد.
در فاز دوم، ترکیبات حاصل، طی واکنشهای کونژوگاسیون، محلول در آب شده و از طریق صفرا یا ادرار دفع میشوند.
متابولیسم و ذخیرهسازی (Metabolism and Storage)
کبد نقشی اساسی در تنظیم و ذخیره مواد مغذی ایفا میکند:
کربوهیدراتها: گلوکز اضافی را به گلیکوژن تبدیل کرده و در مواقع نیاز دوباره به گلوکز تبدیل میکند.
چربیها: اسیدهای چرب را برای تولید انرژی تجزیه میکند، لیپوپروتئین، کلسترول و تریگلیسیرید میسازد.
پروتئینها: آمینواسیدها را تجزیه و از آنها برای ساخت پروتئینهای حیاتی مانند آلبومین و فاکتورهای انعقادی استفاده میکند.
ذخیره مواد: ویتامینهای A, D, E, K, B12 و آهن را ذخیره کرده و در زمان نیاز آزاد میسازد.
این عملکردها برای حفظ انرژی، ساخت سلولها، خونسازی و تعادل بدن ضروریاند.
کبد با تنظیم متابولیسم داروها و تبدیل آنها به ترکیبات فعال یا قابل دفع، نقش حیاتی در اثربخشی و ایمنی دارودرمانی دارد. عملکرد آن تعیینکننده دوز، مسیر مصرف و سمیت احتمالی داروهاست.
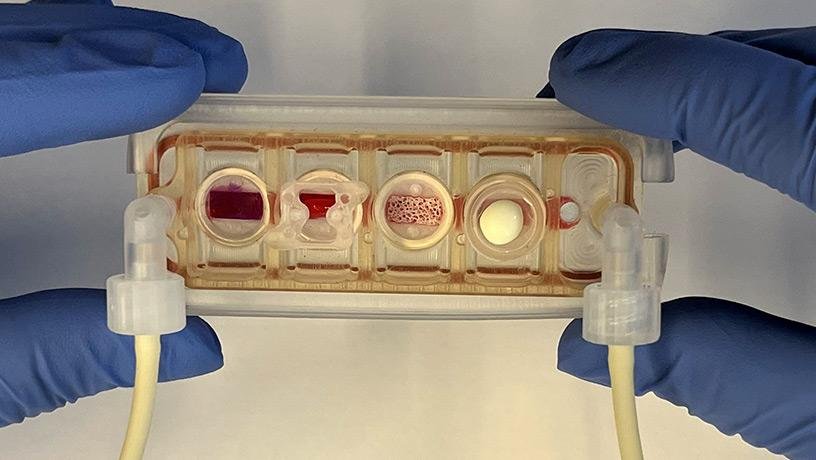
هپاتوسیتها سلولهای اصلی کبد هستند که ۸۰٪ از حجم آن را تشکیل داده و وظیفه انجام عملکردهای حیاتی کبد را بر عهده دارند. با وجود توانایی بازسازی در بدن، نگهداری طولانیمدت این سلولها در محیط آزمایشگاهی چالشبرانگیز است. تکنیک «کشت ساندویچ» روی ژل کلاژن از ۱۹۸۹ معرفی شد و از آن زمان، پیشرفتهای زیادی در نوع داربستها، فاکتورهای رشد و شرایط کشت حاصل شده است. امروزه از منابعی مانند سلولهای بنیادی و ارگانوئیدهای سهبعدی برای تولید هپاتوسیتها و همچنین از بیوراکتورهای پرفیوژن برای حفظ عملکرد طولانیمدت آنها بهره گرفته میشود.
با وجود قابلیت تکثیر بالا در بدن، هپاتوسیتهای جداشده در آزمایشگاه تمایل دارند به سرعت ویژگیهای طبیعی خود را از دست داده و به فنوتیپهای دیگر (مانند مزانشیمی) تمایز یابند. علاوه بر این، تفاوتهای فردی، نحوهی جداسازی و محدودیتهای فنی، کار را برای دستیابی به کشت پایدار دشوار میکنند
یک روش برای جداسازی سلولهای کبدی انسان از بافت سالم کبد که معمولاً برای پرفیوژن مناسب نیست، با استفاده از بافرهای مشابه روش پرفیوژن دو مرحلهای (EGTA و کلاژناز IV) توسعه یافته است. این روش نیاز به لیز گلبولهای قرمز پس از هضم بافت برای جلوگیری از آلودگی دارد و 65 درصد سلولهای کبدی زنده را به دست میآورد. نتایج نشان داد که وزن بافت کبد ارتباط مثبتی با زنده ماندن سلولها دارد. استفاده از قطعات کوچکتر کبد امکان افزایش مقرون به صرفه این روش و جداسازی سلولها بدون پرفیوژن را فراهم میآورد.
ارگانوئیدهای سهبعدی کبدی از خوشههای سلولی خود سازماندهیشده تشکیل میشوند و به زیرلایهها متصل نمیشوند. این ساختارها با روشهایی چون کشت قطرهای آویزان، ریز چاهها، و بیوراکتورهای دوار تولید میشوند. مطالعات نشان دادهاند که کشت سلولهای کبدی در قالب سهبعدی نسبت به کشتهای دوبعدی عملکرد بهتری دارد. به عنوان مثال، کشت سلولهای کبدی در رگ دیواره چرخان و ریز چاهها باعث بهبود فنوتیپ کبدی و عملکرد طولانیمدت شده است. در مدل “هپوئید”، سلولها در ماتریکس کلاژن قرار گرفتند و عملکرد سمزدایی را به مدت 28 روز حفظ کردند.
یک رویکرد دیگر برای کشتهای سهبعدی سلولهای کبدی، مخلوط کردن آنها با ماتریژل برای ایجاد ارگانوئیدهای هپاتوسیتی است. برخلاف کروییدها که از خوشههای سلولی خودسازماندهیشده تشکیل میشوند، ارگانوئیدها معمولاً از سلولهای بنیادی کبدی ساکن یا سلولهای بنیادی پرتوان جنینی یا القایی ایجاد میشوند و بیشتر شبیه به کل اندام از نظر ساختار و عملکرد هستند. این ارگانوئیدها به رشد نامحدود سلولهای بنیادی خود تجدیدشونده و سلولهای بالغ منجر میشوند. مطالعات مختلفی، ارگانوئیدهای کبدی مشتق از کلانژیوسیتهای داخل کبدی را توصیف کردهاند. همچنین، گروههای مختلفی از جمله Nusse و Clevers و هو و همکاران ارگانوئیدهای کبدی مشتق از سلولهای کبدی اولیه موش و انسان را ایجاد کردهاند، اگرچه ظرفیت تکثیر سلولهای کبدی بالغ محدود است. گامبوآ و همکاران نشان دادند که ارگانوئیدهای کبدی مشتق از سلولهای بنیادی کبدی بالغ و HepG2 عملکرد مشابه سلولهای کبدی دارند و ترکیبات مختلفی مانند فورسکولین و Oncostatin M باعث افزایش گسترش ارگانوئیدها میشوند.
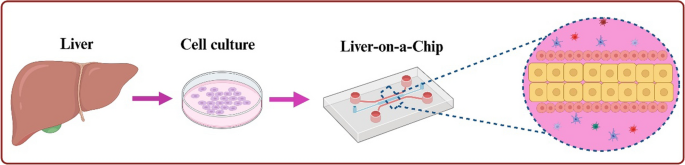
با توجه به چالشهای مطرحشده در نگهداری و عملکرد طولانیمدت هپاتوسیتها در شرایط آزمایشگاهی، بهرهگیری از سیستمهای مبتنی بر میکروسیالات به عنوان یک بستر پیشرفته و قابلکنترل برای کشت سلولهای کبدی، بهویژه در قالب ارگانوئیدها و ساختارهای سهبعدی، ضروری به نظر میرسد. طراحی مفهومی تراشه کبدی (Liver-on-a-chip) با الگوبرداری از ساختار طبیعی کبد، امکان بازآفرینی محیط فیزیولوژیک کبد را در مقیاس میکرو فراهم میسازد.
در این طراحی، سه اصل کلیدی مد نظر قرار میگیرد:
شبیهسازی جریان خون سینوزوئیدی: با طراحی میکروکانالهایی برای جریان مداوم محیط کشت، انتقال مواد غذایی و اکسیژن به شکل طبیعیتری صورت گرفته و سیگنالهای مکانیکی مناسبی به سلولها وارد میشود.
ادغام ساختارهای سهبعدی ارگانوئیدی: با توجه به مزایای کشتهای سهبعدی در حفظ عملکرد سلولی، فضای مرکزی تراشه میتواند شامل محفظههایی برای کشت ارگانوئیدهای مشتق از هپاتوسیتها یا سلولهای بنیادی باشد. برای این منظور، از ماتریسهای زیستسازگار مانند ماتریژل یا ژل کلاژن استفاده میشود که سلولها را درون یک داربست حمایتی نگه میدارند و امکان سازماندهی طبیعی را فراهم میسازند.
کنترل میکرو محیط سلولی (Microenvironment): در طراحی تراشه باید امکان کنترل دقیق پارامترهایی مانند pH، اکسیژن، دما، و حضور فاکتورهای رشد فراهم شود. همچنین، استفاده از پوششهای ECM مانند فیبرونکتین یا لامینین بر روی کانالها و محفظههای سلولی، موجب افزایش چسبندگی و بقای سلولهای کبدی میگردد.
مواد سازنده تراشه نیز نقش تعیینکنندهای دارند؛ استفاده از PDMS بهدلیل شفافیت نوری، زیستسازگاری و قابلیت میکروساخت، بسیار رایج است. این ماده در ترکیب با پوشش ECM یا حتی ترکیبات اصلاحشده جهت کاهش جذب غیراختصاصی دارو، گزینهای مناسب برای کشت بلندمدت هپاتوسیتها محسوب میشود.
با توجه به پیشرفتهای اخیر در میکروسیالات و بیوتکنولوژی، طراحی تراشههای کبدی (Liver-on-a-chip) به عنوان مدل آزمایشگاهی برای شبیهسازی عملکرد کبد و بررسی سمیت دارویی کاربرد فراوانی دارد. این تراشهها با استفاده از ارگانوئیدهای سهبعدی و جریان شبیه خون، محیط کبد را بازسازی کرده و عملکرد سلولها را بهبود میبخشند. این فناوری به تحقیقات دارویی و مدلسازی بیماریهای کبدی کمک میکند و میتواند راهکاری موثر برای تولید مدلهای آزمایشگاهی دقیق و با عملکرد طولانیمدت باشد.
References:
https://www.mdpi.com/2306-5354/10/2/131
https://www.mdpi.com/2073-4360/13/19/3215


